Langfristige Auswirkungen von Influenza-A-Virus-Infektionen auf Lungenzellen und deren Reaktion auf Pneumokokken
Grippeviren (Influenza) können im Alveolarepithel, der Zellschicht, die die Lungenbläschen (Alveolen) auskleidet, epigenetische Veränderungen auslösen – also dauerhafte Veränderungen der Genaktivität ohne Veränderung der DNA selbst. Diese Veränderungen beeinflussen nachhaltig nachfolgende Immunreaktionen und führen dazu, dass der Körper bei einer späteren Infektion mit Pneumokokken nicht mehr angemessen auf die bakteriellen Erreger reagieren kann.
Ein Forschungsteam um Prof. Dunja Bruder (Institut für Medizinische Mikrobiologie und Krankenhaushygiene, UMMD und HZI) hat in der Fachzeitschrift Cell Communication and Signaling neue Erkenntnisse zu den Langzeitfolgen einer Influenza-A-Infektion in einem Mausmodell veröffentlicht. Die Studie zeigt, dass Veränderungen in der Lunge – speziell in den alveolären Typ-II-Epithelzellen (AECII) – über die Viruselimination hinaus bestehen bleiben. AECII sind zentrale Akteure bei Immunabwehr und Geweberegeneration. Die Forschenden untersuchten, wie eine überstandene Grippe deren Reaktion auf verschiedene Pneumokokken-Serotypen beeinflusst. Die Studie erfolgte in enger Kooperation mit der Universitätsklinik für Pneumologie an der UMMD sowie dem Helmholtz-Zentrum für Infektionsforschung (HZI) in Braunschweig.

Foto: Team um Prof. Dunja Bruder (v.l.): Prof. Dr. Dunja Bruder, Dr. Andreas Jeron, PD Dr. Sabine Stegemann-Koniszewski, Dr. Julia Boehme. Fotografin: Melitta Schubert/UMMD
Gefährliche Folgeinfektion mit Pneumokokken
In Folge der Influenzainfektion reagiert das Immunsystem verändert, wodurch schwere Lungenentzündungen durch Pneumokokken begünstigt werden. Diese gehen dann oft einher mit überschießender Entzündung und können die Lunge stark schädigen.
Studienhintergrund und Methodik
Im Rahmen der Studie wurden Mäuse zunächst mit dem Influenza-A-Virus infiziert und anschließend mit verschiedenen Serotypen des Bakteriums Streptococcus pneumoniae (Pneumokokken) erneut infiziert. Dabei analysierte das Team sowohl die bakterielle Ausbreitung in der Lunge als auch die entzündlichen Reaktionen und Veränderungen auf Ebene der AECII.
Ergebnisse und Bedeutung
Besonders deutlich waren die immunologischen Veränderungen beim Pneumokokken-Serotyp 7F: Dieser löste nach vorangegangener Grippeinfektion eine ausgeprägte Entzündungsantwort mit starker Produktion von Typ-I- und Typ-II-Interferonen aus – Botenstoffen, die das Immunsystem aktivieren. Die AECII zeigten zudem epigenetische Veränderungen, welche die Genaktivität langfristig beeinflussten. Dadurch wurde sichtbar, dass die Lunge auch nach Eliminierung des Virus in einem veränderten „Alarmzustand“ verbleibt.
Diese Ergebnisse deuten darauf hin, dass Influenza in der Lunge einen „immunologischen Fußabdruck“ hinterlässt, der die Abwehr gegen spätere bakterielle Infektionen prägt. „Dieses Phänomen, bekannt als ‚trainierte Immunität‘, beschreibt die Fähigkeit von Zellen, sich an frühere Infektionen zu „erinnern“ und darauf basierend ihr Verhalten zu verändern“, erläutern Dr. rer. nat. Julia Boehme und Dr. rer. Andreas Jeron aus der AG Bruder.
Einordnung in den Forschungsstand und Fazit
Die Studie trägt dazu bei, besser zu verstehen, warum bestimmte Pneumokokken-Serotypen nach einer Grippe besonders gefährlich sein können. Zwar sind über 90 Serotypen bekannt, doch nur wenige verursachen invasive, lebensbedrohliche Infektionen. Das Team um Prof. Dunja Bruder konnte im präklinischen Mausmodell erstmals zeigen, wie eine überstandene Influenza-Infektion die Reaktion der alveolären Typ-II-Epithelzellen auf verschiedene Pneumokokken-Serotypen beeinflusst. „Im Gegensatz zu bisherigen Studien, die Sekundärinfektionen meist während der akuten Grippephase untersuchten, zeigt unsere Arbeit, dass die Anfälligkeit für Pneumokokken auch in der Erholungsphase bestehen bleibt – allerdings vor allem gegenüber invasiven Serotypen“, fasst Prof. Bruder zusammen. Die neuen Erkenntnisse über epigenetische und immunologische Veränderungen in AECII liefern wertvolle mechanistische Hinweise darauf, wie vorausgegangene Virusinfektionen die antibakterielle Abwehrfähigkeit der Lunge nachhaltig beeinträchtigen können – ein Aspekt, der langfristig für die Entwicklung verbesserter Therapie- und Diagnoseansätze bei bakteriellen Superinfektionen von Bedeutung sein könnte. Unterstützt wurde die Studie durch die Deutsche Forschungsgemeinschaft (DFG) und die Helmholtz Gemeinschaft Deutscher Forschungszentren (HGF).
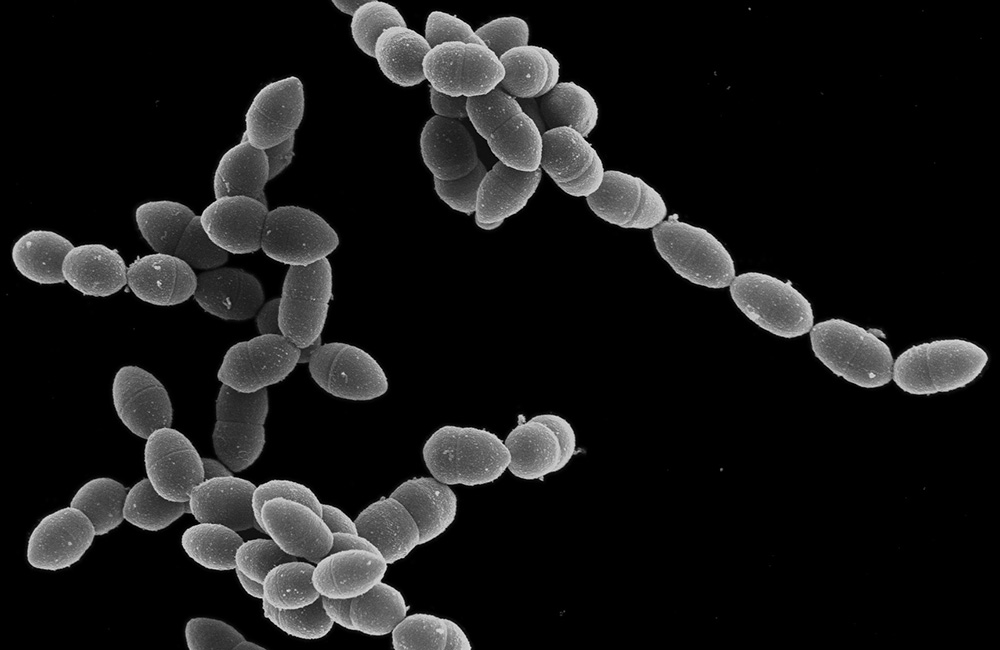
Grafik: Elektronenmikroskopische Aufnahme eines Pneumokokkenstammes. Insgesamt sind bislang über 90 Pneumokokkenserotypen bekannt. © Helmholtz Zentrum für Infektionsforschung (HZI) / Dr. Mathias Müsken (Bild entstand im Rahmen einer Kooperation mit der Abteilung von Prof. Dr. Sven Hammerschmidt, Universität Greifswald)
Publikation
Epigenetic changes and serotype-specific responses of alveolar type II epithelial cells to Streptococcus pneumoniae in resolving influenza A virus infection
Julia D Boehme, Andreas Jeron, Kristin Schultz, Lars Melcher, Katharina Schott, Elif Gelmez, Andrea Kröger, Sabine Stegemann-Koniszewski & Dunja Bruder
Cell Communication and Signaling volume 23, Article number: 278 (2025) Cite this article
https://biosignaling.biomedcentral.com/articles/10.1186/s12964-025-02284-y
Wissenschaftlicher Kontakt
Prof. Dr. rer. nat. Dunja Bruder
Institut für Medizinische Mikrobiologie und Krankenhaushygiene der Medizinischen Fakultät der Otto–von-Guericke Universität Magdeburg
Tel: 0391 67 13374
dunja.bruder@med.ovgu.de
Web: http://immb.med.ovgu.de/





